東大理三合格講師が医学部,難関大合格へ導く化学の個別指導

公式サイトトップ>> 化学の個別指導|医学部受験対策
医学部,難関大合格へ導く化学の個別指導
医学部,難関大に合格するためには理科科目での安定した得点が武器になります。 ことに多くの医学部,難関大受験生が選択する「化学」で 大きな失点は避けたいと同時に出来るだけ高得点を獲得したいです。
以下のコンテンツでは、(株)合格の天使が個別指導として行っている 科目・質問数無制限の説明指導・回答指導・添削指導について、 当塾が誇る東大理三合格・東大医学部医学科講師の実際の化学の回答を掲載していきます。 これが受講生の化学を得意科目に押し上げ医学部難関大に驚異的合格率を誇る当塾の充実指導の証拠です。
「受験生として実際に具体的に何を指導から得ることが出来るか、指導側がどの次元・レベルで実際何を与えているか」 このことは事実と異なるものを安易に語る人間がいる指導実績・合格実績や口先だけの仮装の実力や指導内容と異なり、決して操作することが出来ない事実、ごまかすことが出来ない事実です。
以下が受講生の実力が圧倒的に伸びる合格の天使の指導の秘密の一部であり、 徹底した責任指導・個別指導であるがゆえに少数受講生でありながら医学部医学科,難関大へ 驚異的合格率を叩き出している事実と証拠です。
以下に掲載するものはごくごく一部の質問と回答であり、1人の受講生がたった1回の質問回答で得られるものよりもはるかに少ない量です。 当塾の受講生はここに掲載している回答を化学に限らず全教科、 1回に~10問程度、フリーコースの受講生は週に30~100問という量で得ていっているのです。 これで実力が伸びないはずがないことはお分かりいただけると思います。
受講の有無にかかわらず、化学を効率的にマスターするために 問題集や参考書にどう取り組んでいくべきなのか、 何を得ていくべきなのかを具体例からしっかりと学んでください。
【目次】の化学の個別指導の実際の質問回答
【目次】クリックで質問,回答へ飛べます
医学部入試化学でケアレスミスを防ぐための参考書への取り組み方
適宜更新をして質問回答を今後大量に出していきます。
指導内容・コース・受講料の詳細はこちらから▼
質問回答を有効活用していただくための3つのポイント!
注意1
実際に受講生からいただくご質問には教科書、問題集、参考書、過去問集の該当の問題の全文の画像がありますが、ここでは割愛させていただきます。
受講生からのご質問については、著作権上実際の問題集の問題をそのまま使用できませんので、
ほとんどのご質問および回答をここに掲載するために一般化していることをあらかじめご了承ください。
(実際には問題集や過去問などの具体的な問題のご質問に具体的数値や具体的状況に応じたきめ細やかな回答、解説を行っています。)
【最重要視点】
個別具体的な問題の解法を掲載しそれを詳しく解説することは極めて容易なことです。数百でも数千でもいくらでも掲載できます。しかし、そんなものをいくら見たところで、集めたところで、それは問題の数だけ解法や解法へのアプローチを学んでいるにすぎず、個々的な問題に対しての解法や解法へのアプローチを集めているだけです。これは初見の問題に対しては全くの無力です。そんなものゴミです。初見の問題を解けるようにならない解説なんて何の役にも立ちません。
これにちゃんと気づけている受験生が狭き門をかいくぐり合格を手にする受験生であり合格の天使のポストやコンテンツを見ていただいている受験生です。
具体→抽象→一般化
これが問題を学ぶ際の重要思考作業です。
一般化された知識→具体的問題への還元
これが初見の問題を解く際の重要思考作業です。
このためにあえて合格の天使のコンテンツやポストでは
受講生の質問を一般化
講師の回答も一般化
受講生の質問を一般化
講師の回答も一般化
しているのです。
これは合格の天使の指導でも同じです。
まず受講生がわからない個別具体的な問題を説明・解説する。でもその問題だけでなく関連問題やその分野の問題を解けるように一般化した説明・解説も加える。これにより初見の問題にも効率的に対処していけるようになるのです。
ただこれは実力的にもノウハウ的にも誰にでもできる解説ではありません。
選別され、かつ、「専属契約」で2008年創業以来のノウハウを共有している合格の天使の東大理三合格講師陣からこの部分の非常に優れたものを得ることができるのが合格の天使の受講生なのです。
また、著作権などの法令遵守の観点から合格の天使では安易に問題集の問題や過去問そのものや自作でない図形、画像をポストなどに掲載しないようにしています。これは本来当然のことです。
指導側の都合、利益ではなく受験生にとって合格に必要なものをご提供する。 受験指導機関である以上法令遵守は当たり前。 これが合格の天使の理念です。
注意2
当塾指導は受講生の現在の理解レベルや状況に応じて質問回答を行います。
入塾試験を課していないため受講生の実力はバラバラです。
そのため極めて基本的なご質問およびそれに対する回答も丁寧に行います。
簡潔に表現すると合格の天使の指導は「質問回答もオーダーメイド」です。
同じ分野や同じ問題の質問でも受講生によって回答レベルを変えています。
当塾の徹底指導の理念及び単なる東大理三合格者ではない人柄も優れた東大理三合格講師集団だからなせる指導です。
この点も考慮して回答をご覧ください。
注意3
ここに掲載する回答は、毎日受講生から頂く多くのご質問に対するごくごく一部をご紹介するものです。
すなわち、1人の受講生が1日に数問~10問程度の質問、1日トータルで百~数百問、1か月で数千~数万問、1年で数万~数十万問、数年で数十万~数百万問という膨大な数の質問回答の中からランダムに1問ずつ取り上げて掲載するものです。
難関大学二次試験 化学難化のパターンと対処法まとめ
受講生の質問
難関大学の二次試験で化学が難化した場合どう対処したらいいか
回答
難化するパターンは絞れます。そのパータンと対処法をまとめました。

医学部入試化学でケアレスミスを防ぐための参考書への取り組み方
受講生の質問
医学部入試の化学でケアレスミスを防ぐために参考書にどのように取り組むべきか
回答

塩の酸、塩基の判断、塩の酸塩基の強弱の判断の方法
受講生の質問
塩の酸、塩基の判断、塩の酸塩基の強弱の判断の方法がわかりません。 何由来の酸なのか、塩基なのかを判断するところからよくわかっていません。
回答

アミノ酸20種類は全て覚えなければならないか
受講生の質問
アミノ酸20種類は全て覚えなければいけないのですか?
回答

油脂計算これだけ!
受講生の質問
油脂計算が苦手です。ポイントがあれば教えてください。
回答


シュルツ・ハーディの法則?
受講生の質問
解説では、価数の大きいイオンほど、凝析しやすいと書かれていますが、塩化カルシウムの場合、電離して、塩化物イオンを2つ放出するので、2価のイオンである硫酸イオンとあまり変わらないように感じたのですが、どうして硫酸の方が凝析しやすいのですか?
回答
凝析において重要なのは、イオンの総電荷ではなく、イオンの価数であることが知られています。高校範囲外なので、覚える必要はありませんが、シュルツ・ハーディの法則という法則があり、「凝析能力はイオンの価数の6乗に比例する」という法則が成り立ちます。
したがって、硫酸イオンは塩化物イオンの64倍の凝析能力を持つため、塩化物イオンが2つあったところで、硫酸イオン1つに敵わないというわけです。
鉛蓄電池の反応式の原理
受講生の質問
鉛蓋電池の反応式の原理がわかりません
回答

ルシャトリエの原理の落とし穴
受講生の質問
C(黒鉛)+CO2(気体)⇔2CO(気体)という化学反応について、温度一定でゆっくりと体積を小さくしたときに「CO/CO2分圧比は減少し、CO2とCOの分圧はともに上昇する」とありますが、 ルシャトリエの原理で考えると平衡が左に移動するので、CO分圧は減少し、CO2分圧は増加する と考えました。どうしてCO分圧も増加するのですか?
回答
これはルシャトリエの原理の落とし穴に関する話です。
実は、平衡が移動する=移動する前のものが減って、移動した先のものが増える とは限らないのです。つまり、C+CO2→2COという平衡が左に移動したとしても、COもCO2も量が増加することがありえる ということです。
ルシャトリエの原理の基本となる考えは「変化を和らげる方向に平衡が移動する」というものです。注意すべきは、「変化が完全に帳消しされる」わけではないということです。
結論を先にいうと
・ルシャトリエの原理はあくまで変化を和らげるだけ
・なので、体積を小さくした瞬間(平衡が成り立つ前)はCO2もCOも圧力が上昇する
→平衡が成り立った後もCO2もCOも圧力は上昇したまま ただし平衡がCO2側に移動しているのでCO2分圧のほうがより大きく上昇している
となります。「変化を和らげるだけ」というのは「上昇したCO分圧を元通りにするほどにはルシャトリエの原理は強くない」ということです。
そうなる理由を数式的に考えてみましょう(必須ではないですが、以下のように考えると応用が利きます。なので、できれば身に着けておきたい考え方です)。
ルシャトリエの原理が成り立つ根拠は「温度が一定なら、平衡定数Kも一定」 というものでした(温度が変わる問題はとりあえずおいておいて、圧力や物質量を変える問題に限りましょう)
この問題で言うならば平衡定数K=[CO]^2/[CO2]が常に一定である ということです。ルシャトリエの原理は「この値を一定にするために平衡が移動する」というものなのでした。 ※圧力の平衡定数ならP(CO)^2/P(CO2)が一定という事です。以下、こちらのほうが考えやすいのでこちらで話を進めます。
全体の圧力が2倍に増えたとしましょう。すると、平衡を考えないとP(CO)もP(CO2)も両方とも2倍になってしまいます。 ※P(~)=~の分圧 すると、P(CO)^2/P(CO2)は全体で2倍になってしまいます(分子のP(CO)が二乗なので、4倍/2倍となり全体が2倍になってしまうから)。 これだと平衡定数が2倍になってしまいおかしいので、一定に戻すためにP(CO)を減らしてP(CO2)を増やそうとなるのです。 このとき、もしもこれでP(CO)が減りすぎてしまったとしたら、今度は逆に 小さいP(CO)^2/大きいP(CO2)となり、平衡定数が小さくなってしまいます。
ではどうすれば一定になるのかというと、やや大きくなったP(CO)^2/大きいP(CO2)という中途半端な所で終われば一定になります。
これがルシャトリエの原理が完全に変化を打ち消すのではなく、あくまで変化を和らげるだけ ということの理由です。
いちいち数式的に考えると時間がかかってしまいます。
ルシャトリエの原理は厳密には変化を和らげるだけで、完全に帳消しにするほどの力は持っていない と捉えておけばとりあえずはOKです。
慣れてきたら、ややこしい時に備えて「平衡定数を一定にする」という考え方も身に着けておきましょう。
有機化学の構造決定
受講生の質問
有機化学の構造決定がうまく解けない。どうすれば良いか。
回答
まず、問題文を読みながら何から何ができたのか、何がどういう性質を持っているのかをメモします。一通り問題文を読み終わった後はわかりやすい化合物から順に決定していきます。多くの場合、分子量が小さいもの、もしくは分子式がわかっている化合物が構造式を決定しやすいです。
分子量も分子式もわからない場合、化合物を燃焼して生じた水や二酸化炭素の量から分子式を決定するという問題も頻出です。
多くの問題はこのような化合物を論理立てて候補を絞っていけば答えがわかるので、この手の問題は間違えないように演習します。
ここまでで、多くの問題は解けるようになりますが一部の問題は、分子量も分子式もわからない状態だが、典型的な記述があるから多分この化合物といった決め打ちで解きます。例えば還元性のあるカルボン酸で分子量が90といった情報を見た時、おそらくシュウ酸といった具合に解きます。このように、典型的な記述からわかる問題は必要十分性を考えて答えがただ一つわかるわけではないです。
しかし、こういった解き方が求められる化合物は限られているので閃きというより知識問題に近いので演習によりカバーできます。
もし、典型的な記述から一発で化合物を推測する問題があったら、その記述と化合物は対応させて覚えておくと良いです。
また、官能基の分子量は覚えておくと良いです。メチル基が15で、カルボキシ基が45といった具合で覚えておくと、構造決定の詰めの部分で分子量から何の官能基がついているのかを推測しやすくなります。
弱酸・弱塩基の電離問題
受講生の質問
弱酸や弱塩基の電離、例えば酢酸の電離を例に考えると、 CH3COOH→CH3COO-+H+ において、pHを求めるような問題で、 水の電離によるH+の濃度変化を考えなくて良いのか。
回答
もし水による電離の量を初めから考慮して式を立てると、(酢酸の最初の濃度をC0=1.0*10^-1,電離定数Ka=2.0*1.0^-5として考えています。)下のようになります。
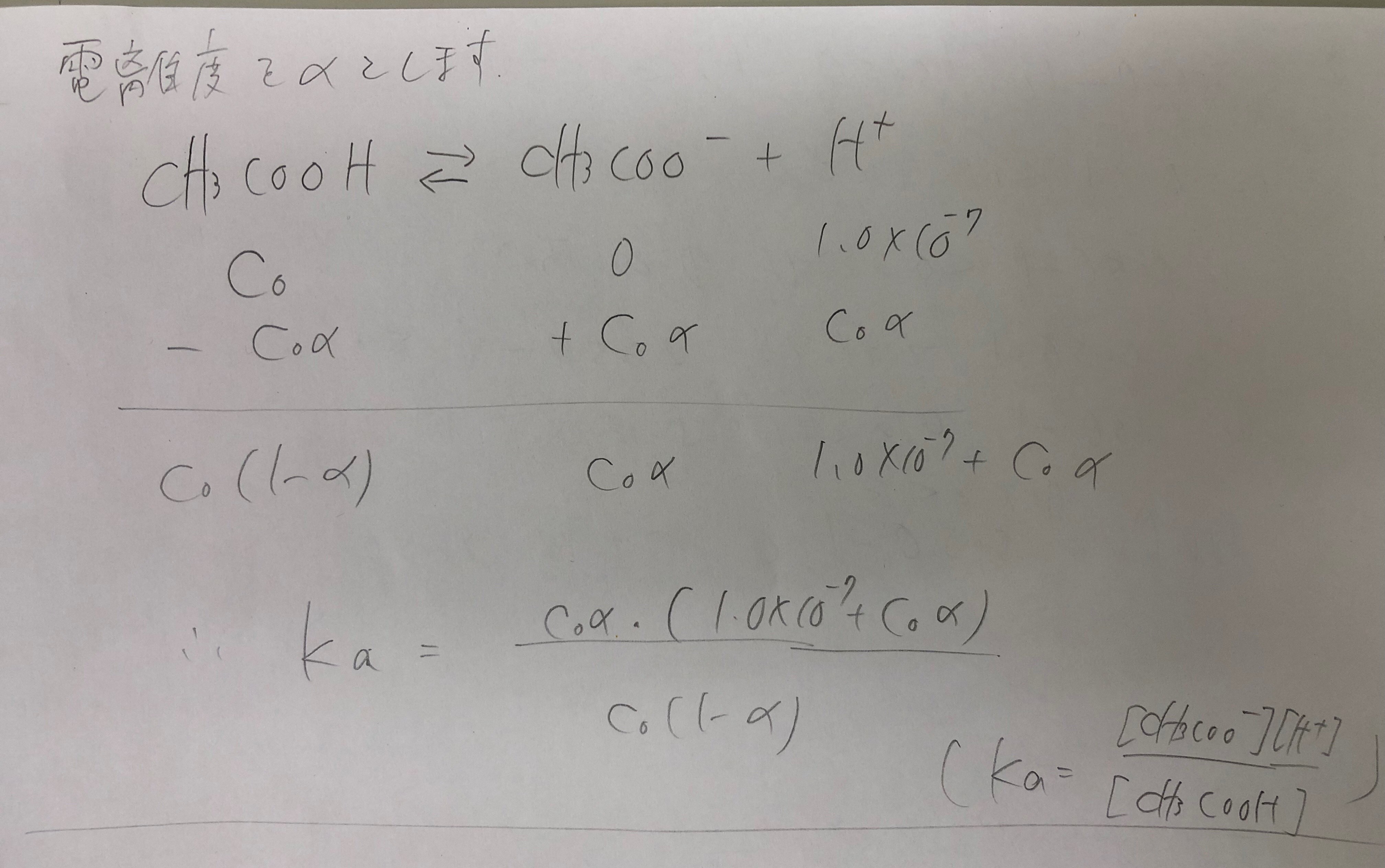
これだと式が複雑すぎてとけなくなります。そこで、水の電離による水素イオンの濃度は無視できると仮定して計算してみます。 そうすると下のようになります。

水の電離を無視した仮定の元で計算すると[H+]=1.4*10^-3と求められました。もともとあった水素イオン濃度は1.0*10^-7なのでこれらを比較してみると、電離によって生じたH+の方が圧倒的に多いことがわかります。(10000倍以上あります。)ですので、水の電離を無視できるという仮定は正しかったことがわかります。つまり、1.4*10^-3>>1.0*10^-7より、C0α+1.0*10^-7はC0αと近似して良いということです。
単体・化合物・混合物の区別の視点
受講生の質問
よく問題で
次の(a)~(g)を単体・化合物・混合物に分類せよ。
(a) 氷 (b) 空気 (c) 鉄 (d) 水素 (e) 海水 (f) インク (g) 石英 (h)塩酸
とありますが、混合物と化合物の違い、また単体と元素の違いを教えて下さい。いつもこの問題で必ず間違えて混乱します。
回答
「元素」とはHやClなど、元素記号で表される「物質の成分」です。
物質をこれ以上、分解して簡単な物質にすることは出来ません。
この元素が集まって物質は作られます。
例えば水分子は、水素と酸素という2種類の元素から成るわけですね。
1種類の元素からなる物質を、「単体」といいます。
例えば鉄という物質は、鉄Feの原子がたくさん集まってできたものです。
Feという1種類の原子しか含まないので、鉄は単体です。
一方先に挙げた水は、水素原子と酸素原子が含まれていました。
このように、2種類以上の元素が含まれる物質を「化合物」といいます。
この「単体」と「化合物」は、いずれも1種類の物質として数えます。
1種類の物質だけから成るものを「純物質」といいます。
例えば水は、水分子H2Oが無数に集まって出来ていますが、どの分子もH2Oという同じ「化合物」なので、これらの集合である水は「純物質」です。
一方、海水には「水」という物質のほかに、塩、つまり「塩化ナトリウム」や「塩化マグネシウム」など、沢山の種類の物質が含まれています。
このように、複数種類の物質からなるものを「混合物」といいます。
以上を踏まえて問題の各選択肢を考えてみましょう。
氷 : 水が凝固したもので、水は前述のとおり、H2Oという1種類の分子だけが無数に集まったもので「純物質」です。さらに、H2OにはHとOという2種類の元素が含まれるので「化合物」です。
空気 : 空気には、「窒素」「酸素」「アルゴン」などの数種類の「純物質」が含まれます。なので「混合物」です。
鉄 : 前述の通り、Fe原子だけからなる「純物質」です。さらに、Feという元素だけしか含まないので「単体」です。
水素 : 水素の分子は、H2で表され、水素原子Hが2個結合したものです。1種類の分子からなるので「純物質」、それぞれの分子は水素からのみなるので「単体」です。
海水 : 前述のとおり、複数の物質を含むので「混合物」です。
インク : パッとは考えにくいですが、「水」の他、色素など様々な「純物質」が含まれることは推測できますので、「混合物」です。
石英 : 石英というのは二酸化ケイ素のことです。これはSiO2という式で表されますが、二酸化ケイ素という物質からのみでなるので「純物質」です。SiO2はケイ素元素Siと酸素元素Oを含むので、「化合物」になります。
塩酸 : 塩酸は間違えやすいですが、これは塩化水素という「純物質」を水という「純物質」に溶かしたものです。つまり「水」と「塩化水素」という2種類の物質を含んでいるので、「混合物」です。
【ポイント】
「純物質」というカテゴリの中で、さらに別れて「化合物」と「単体」がありますから、「化合物」なら自動的に「純物質」になります。
「人間」のカテゴリの中に「男性」「女性」があるようなものです。「男性」ならば自動的に「人間」のカテゴリにも含まれますね。
「単体」である水素の場合も同様です。
「混合物」と「化合物」の違いについては、「混合物と純物質の違い」と、純物質の中での「単体と化合物の違い」は、別々に考える。
分類の際は、まず「混合物と純物質の分類」を考えます。その違いは、「1種類の物質からなるか、複数の物質を含むか」です。
「純物質」と分類されたら、その中で「単体と化合物の分類」を行うわけです。「1種類の元素からなるか、複数の元素を含むか」ですね。
回答掲載解説
問題集やセンター試験の過去問集でのこの部分の説明って理解・納得できますか?
この部分の説明は結構曖昧・簡素だったりしますよね。
その結果、単に丸暗記をしてしまっていませんか?
単に丸暗記をしている状態というのは気づきにくいものなのでちょっとチェックしてみてください。
まず単に丸暗記をしていると、問題集や参考書を何度も繰り返さないと覚えられないという状態が生じます。
これを裏から捉えると、とりあえず覚えるためには問題集や参考書は何度も繰り返さなければならない、闇雲に問題集や参考書は何度も繰り返すべきという勉強になります。(もちろん単純暗記物はそうすべきこともありますが)
そして忘れないうちに復習しなければという状態になります。
常に強迫観念の元に勉強しながら、それでいて得ているものは不確実なものという状態が生じてしまうのです。
今回取り上げた問題など化学のたった一部、さらには受験全科目でいえば微々たる一部です。
ここで気づいていただきたいのは、理解すべきことを理解しない勉強をしていると、受験科目すべての分野や問題について、膨大な範囲や分野・項目について何度も同じことを繰り返さなければならない、何度も繰り返さなければ覚えることが出来ないという状態が生じてしまうのです。
そういう方向へ日々の勉強が向かってしまうのです。
しかし、たとえその方法で覚えたところでそれは本質的な理解が伴っていないからその都度不安になる、確実に得点できない、すぐに忘れてしまうのです。
だから勉強時間は膨大になる、どんなに勉強しても得点に結びがつかないということが起きてしまうのです。
さらに理解すべきことを理解していないと本番では最悪な状況を招きます。
それは、「あーだこーだ迷って時間を浪費する」「やったはずなのに思い出せない」「出来ない」という状況です。
これは、精神的にも、全体の得点にも非常に悪影響を及ぼす事実です。
勉強効率においても、本番においても大きなデメリットがあるこのような勉強は改善していきましょう。 常にこの大きなデメリットについては頭に入れて日々の勉強に取り組んでください。
とても、大事なことですので皆さんに問います。
今回の回答の内容をしっかり理解していれば何度も何回も何問もこの部分の問題集や参考書を繰り返す必要がありますか?
この理解を確認するためだけに数問問題を解けばこの部分は完璧になりませんか?
これを受験科目全体という範囲、分野・項目で考えてみてください。
確実な実力をつけるためどれだけ莫大な時間を省略できますか?
どれだけ莫大な労力・精神的な負担を軽減できますか?
この回答をした東大理三合格講師槇の再受験時の1日の勉強時間は4~5時間です。直前期ででもです。
数年の受験勉強のブランクを経て再受験の受験勉強期間は一年足らずでです。
この回答掲載解説をご覧いただければ、もともと頭がいいからとかもともとできるからとかそういった根拠のない理由ではなく、確実に実力をつけた、圧倒的実力をつけた背景には確固たる根拠がある、方法論があることはお分かりいただけると思います。
そしてそれはこれを読んでくださっているあなたにも可能なことであるということもわかっていただけるはずです。
合格へ向かってください。
「でも・・・」「だって・・・」「自分には・・・」とどうしてもまだ思ってしまいますか?
そんな方に実例を。
当塾の受講生はネット塾・リアル塾問わず常にこの質の高い質問回答指導を科目・質問数無制限で得ています。
そして映像講義では今回のような各科目の理解の核となる部分について網羅的にご提供しています。
だからこそ頑張りさえすれば医学部医学科突破という圧倒的実力を手にしているのです。
まずは今回お伝えしたことを真剣に考え日々の勉強に取り組んでください。
莫大に無駄になっている勉強時間や労力、精神的負担をまずは自分で減らす勉強をしていってください。
蒸気圧降下とは
受講生の質問
純溶媒に不揮発性物質を溶かすとなぜ溶液の蒸気圧が下がるのかがよく分かっていないのですが、イメージしやすいような理解の仕方はないでしょうか? 溶媒分子の割合が減少しても加えられた物質は不揮発性物質であるのになぜ液体表面から蒸発する溶媒分子の数が減少するのか理解出来ていません。
回答
・蒸気圧降下がどういうものか
液体表面の様子をイメージしてみましょう。
例えば水に食塩が溶けているとします。水分子はランダムに動いていますが、勢いの良いやつは水面から飛び出して気体として飛び回ります。
逆に、気体の状態から水面に飛び込んでくるやつもいるので、それらがどこかでバランスの取れた状態になっています。その平衡状態を表すのが飽和蒸気圧です。
食塩があると、水分子が飛び出そうとしても邪魔をしてしまうのです。 なので純粋よりも飛び出す分子が減少するわけですね。
結局、教科書の図において溶質粒子は「邪魔者」と考えてください。
沸点上昇の考え方
受講生の質問
蒸気圧が低いものの方が早く乾くと考えてしまったのですが、なぜ蒸気圧の高い純粋な水で濡れた服の方が乾きやすいのでしょうか? これが分からないのは蒸気圧と沸点の違いがよく分かっていないからでしょうか。
回答
・沸点上昇の考え方
蒸気圧とは上に書いた通り、「どれだけ気体として存在できるか」を示した数値です。
蒸気圧が低い=気体として存在しにくいということです。
したがって、純物質のほうが蒸気圧が高く、気体として存在できる量が多いので、蒸発しやすいということです。
例えば、温度が高いほど洗濯物が乾きやすいのはイメージしやすいと思います。
蒸気圧というのは温度が高いほど増加するので、気体として出ていきやすいということですよね。
沸点に関しては、「蒸気圧=大気圧である温度」という明確な定義があります。 同じ温度で蒸気圧が低い⇔大気圧と等しくするにはたくさん温度を上げる必要がある⇔沸点が高い ということになるのです。
それが沸点上昇の原理ですね。
蒸気圧曲線
受講生の質問
蒸気圧曲線についてです。これは、曲線の上にある状態だと、液体が生じるという程度の認識で対処できますか?
回答
まあそれで良いと思います。厳密には、分圧が飽和蒸気圧を越えることはないので、もし計算した分圧がそうなったら、実際には一部液化していて、分圧=飽和蒸気圧になっているということですね。
よって考える手順としては、
まずすべてを気体と仮定して分圧を求める
→分圧<飽和蒸気圧ならそのまま
分圧>飽和蒸気圧なら上記の通り
という風に計算するのが一般的です。
イオン半径
受講生の質問】
イオン半径についてですが、元素記号で O,F,Na,Mg,Alのように全て同一の電子配置をもつイオンの場合、 原子番号が大きくなるイオンほどイオン半径は小さくなると書かれていますが、なぜですか? 同一の電子配置を持つわけですからO,F,Na,Mg,Al はみんなイオン半径は同じではないのでしょうか。
回答
確かに、これらのイオンは電子配置は同じです。
しかし、それ以外で異なるものがあります。原子核に含まれる陽子の数に注目してみましょう。
陽子の数は、原子番号と等しいですね。
そして1個の陽子は、1個の電子と反対の符号で、同じ大きさの電荷を持ちます。
電子の電荷は負なので陽子の電荷は正になります。
したがって、陽子数が増えるほど原子核中の正電荷は大きくなります。
ここでちょっと、物理の電磁気の話に入るのですが、正負の電荷はクーロン力により引き合います。
原子内でも、原子核の周りの電子は、正電荷を持つ原子核に引きつけられています。
この力は電荷が大きいほど強くなるので、電子配置が同じイオンでも、 陽子数が多いほど原子核による引力が強くなります。 原子核の正電荷が大きくなるからです。
したがって、原子番号が大きいほど電子は中心に強く引き寄せられるので、イオン半径は小さくなります。
回答掲載解説
個人個人疑問点や不明点は異なります。 ですのでこの疑問についてしっかり説明できる方もいれば曖昧な方もいると思います。
大事なことはとにかく日々の勉強で自分の疑問点や不明点はしっかりと解決していくということです。
個人個人疑問点や不明点は異なる、それを前提に自分にとっての疑問点・不明点をしっかり解決していくことが実力を効率的につけていくための核です。
今回の問題の部分についても指導によっては問題集や参考書は何回も繰り返せば実力がつくと言われ、肝心な理論の説明がなされないものも多々あるようです。
でも、それでは本質的な理解はできない=センター試験の問題では何とか正解を導けても、2次試験の問題では得点はできません。
今回の問題は極めて簡単な例ですが、お伝えしたいことは、
本質的な理解を伴わない理解や説明では、問題の数だけ理解や説明があることになってしまうのです。
覚えることをだけを増やし、時間だけがかかり、でもそれをいくら繰り返しても応用力や初見の問題に対処する実力はつかないということです。
1つずつでいいので皆さんも日々の勉強での疑問点や不明点はしっかりと解決して行ってくださいね。
近似の計算
受講生の質問
310の画像についてです。この問題で勝手に近似を行っていますが、近似はどういった時に行うものなのでしょうか?
【回答】
うーん中々重い計算ですね。2次方程式を解かせるのは、化学の計算の中で最も重いものになると思います。 ほぼ必ずルートが出てくるので、その場合には近似を使わないととても自力で計算などはできないわけです。 よって今回のような√の計算では近似を使うと考えてよいです。
ほかにも
・ある値と、それに比べてはるかに(具体的には「問題で指定された有効数字+1桁」以上)小さい数を足し引きするとき(1.8×10^5 + 2.3×10とか)
・有効数字2桁以上の数(1.8×10^5 とか)の、2乗や3乗を計算するとき
などにはとても計算できないので、近似を使ったほうが良いかと思います。
次回以降へ続く・・・・・
指導内容・コース・受講料の詳細はこちらから▼






